สมดุลเคมี
สมดุลเคมี
chemical engineering
- สมดุลเคมี (Chemical equilibrium) คือสภาวะที่ความเข้มข้นของสารตั้งต้นและสารผลิตภัณฑ์ไม่เปลี่ยนแปลงอีกแม้เวลาผ่านไป เราจะเรียกว่าปฏิกิริยาเคมีนั้นอยู่ในสมดุล (equilibrium)
กระบวนการเปลี่ยนแปลงทางวิทยาศาสตร์มี 3 รูปแบบ คือ การเปลี่ยนสถานะ การละลาย และการเกิดปฏิกิริยาเคมี จำแนกเป็น 2 ลักษณะคือ
- การเปลี่ยนแปลงที่เกิดขึ้นทางเดียวไม่ย้อนกลับ (Inreversible reaction) หมายถึงเมื่อสิ่งหนึ่งเปลี่ยนแปลงไปเป็นอีกสิ่งหนึ่งแล้ว สิ่งที่เกิดขึ้นจากการเปลี่ยนแปลงนี้จะไม่สามารถเปลี่ยนกลับมาสู่ภาวะเดิมได้โดยทันที เช่น การเผาไหม้ของสิ่งต่าง ๆ เราไม่สามารถทำให้สิ่งที่เกิดจากการเผาไหม้ เปลี่ยนกลับไปเป็นสารเดิมเหมือนก่อนการเผาไหม้ได้อีก การเปลี่ยนแปลงลักษณะนี้ไม่มีภาวะสมดุล เช่น ปฏิกิริยาการเผาไหม้ดังสมการ
CH4(g) + O2(g) CO2(g) + H2O(g)
- การเปลี่ยนแปลงที่ผันกลับได้หรือย้อนกลับได้ (Reversible reaction) มีลักษณะที่สำคัญคือเมื่อสิ่งหนึ่งเปลี่ยนแปลงไปเป็นสิ่งใหม่แล้ว สิ่งใหม่ที่เกิดขึ้นก็สามารถเปลี่ยนกลับมาเป็นสิ่งเดิมได้ทันที การเปลี่ยนแปลงลักษณะนี้จะเกิดภาวะสมดุลขึ้นได้ เช่น การผลิต ก๊าซแอมโมเนีย (NH3) จากปฏิกิริยาระหว่างก๊าซไฮโดรเจน (H2) กับก๊าซไนโตรเจน (N2) ดังสมการ
3 H2(g) + N2(g) ↔ 2NH3(g)
ในการเกิดปฏิกิริยานี้ ก๊าซ H2 และ N2 เป็นสารตั้งต้น ทำปฏิกิริยากันกลายเป็นก๊าซ NH3 และในทันทีที่เกิดก๊าซ NH3 ก๊าซ NH3 ที่เกิดขึ้นจะสลายตัวกลับไปเป็นก๊าซ H2 และ N2 อย่างเดิม ฉะนั้นในเวลาเดียวกันจึงมีการเปลี่ยนแปลงเกิดขึ้น 2 กระบวนการพร้อมกัน ได้แก่
2.1 ก๊าซ H2 กับ N2 ทำปฏิกิริยากันกลายเป็นก๊าซ NH3 ดังสมการ
3 H2(g) + N2(g) → 2NH3(g)
กระบวนการนี้เกิดขึ้นก่อน เรียกว่าการเปลี่ยนแปลงไปข้างหน้า (forward change หรือ forward reaction)
2.2 ก๊าซ NH3 บางส่วนสลายตัวกลับมาเป็นก๊าซ H2 กับ N2 ตามเดิม ดังสมการ
2NH3(g) → 3H2(g) + N2(g)
กระบวนการนี้เกิดขึ้นทีหลัง เรียกว่าการเปลี่ยนแปลงย้อนกลับ (reverse change หรือ reverse reaction) เมื่อนำการเปลี่ยนแปลงทั้ง 2 มาเขียนไว้ในสมการเดียวกัน รูปของสมการจะเป็นดังนี้
2NH3(g) ⇌ 3H2(g) + N2(g)
- ภาวะสมดุล หมายถึง ภาวะที่ระบบมีสมบัติคงที่ หรือภาวะที่สารตั้งต้นและสารผลิตภัณฑ์ทุกชนิดมีปริมาณหรือความเข้มข้นคงที่ หรือภาวะที่อัตราการเปลี่ยนแปลงไปข้างหน้าเท่ากับอัตราการเปลี่ยนแปลงย้อนกลับ
สมบัติของระบบ ณ ภาวะสมดุล
1.ต้องเป็นปฏิกิริยาที่ผันกลับได้ โดย ต้องเกิดในระบบปิด
2.มีปฏิกิริยาไปข้างหน้าและย้อนกลับเกิดขึ้นตลอดเวลา โดยจำนวนโมลของสารตั้งต้น และผลิตภัณฑ์คงที่แต่อาจเท่ากันหรือไม่เท่ากันก็ได้ และ อัตราการเกิดปฏิกิริยาไปข้างหน้าเท่ากับปฏิริยาย้อนกลับ
3.สมบัติของระบบคงที่ (จำนวนโมลคงที่ สีของสารคงที่ ความดันคงที่ และอุณหภูมิคงที่)
ภาวะสมดุลระหว่างสถานะ สารต่างๆสามารถเปลี่ยนสถานะได้ โดยมีการเปลี่ยนแปลงพลังงานควบคู่ไปด้วย ดังแผนภาพนี้
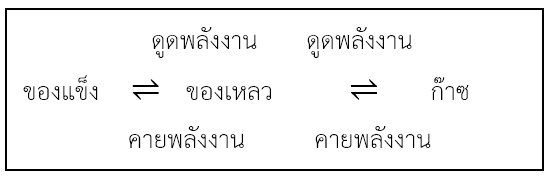
ที่ภาวะสมดุลของปฏิกิริยาเคมีระบบยังมิได้หยุดนิ่ง ยังมีทั้งการเกิดปฏิกิริยาไปข้างหน้า และเกิดปฏิกิริยาย้อนกลับตลอดเวลาโดยเกิดในอัตราที่เท่ากัน เรียกภาวะสมดุลนี้ว่า ภาวะสมดุลไดนามิก
ภาวะสมดุลในสารละลายอิ่มตัว เมื่อให้ตัวถูกละลาย ละลายในตัวทำละลาย ตัวถูกละลายก็จะละลายได้เร็วในตอนแรกแล้วละลายได้ช้าลงและเมื่อเกิดสารละลายอิ่มตัว เราจะพบว่าตัวถูกละลายไม่ละลายต่อไปอีก ไม่ว่าจะคนสารละลายเป็นเวลานานเท่าใดถ้าอุณหภูมิคงที่ เมื่อตั้งสารละลายอิ่มตัวไว้จะเกิดผลึกขึ้นและปริมาณของผลึกจะเพิ่มขึ้นเรื่อยๆจนในที่สุดผลึกคงที่ เรายังดูเหมือนว่าไม่เกิดผลึกอีก แต่ในระบบผลึกยังคงเกิดขึ้นเรื่อยๆแล้วก็ละลายในสารละลายอีกด้วย
สมดุลในปฏิกิริยาเคมี คือ ปฏิกิริยาเคมีที่เกิดภาวะสมดุลจะต้องเป็นปฏิกิริยาผันกลับได้ และ สมบัติของระบบต้องคงที่ การศึกษาภาวะสมดุลของปฏิกิริยาเคมี ตรวจสอบดังนี้
ทดสอบปฏิกิริยาไปข้างหน้า (สารตั้งต้นทำปฏิกิริยากันแล้วเกิดเป็นสารผลิตภัณฑ์หรือไม่)
ทดสอบปฏิกิริยาย้อนกลับ (นำสารผลิตภัณฑ์มาทำปฏิกิริยากันแล้วกลับไปเป็นสารตั้งต้นหรือไม่)
สังเกตสมบัติของระบบว่าคงที่หรือไม่ (อาจสังเกตสีว่าคงที่หรือไม่)
การเปลี่ยนแปลงที่ก่อให้เกิดสมดุลเคมีต้องเป็นการเปลี่ยนแปลงที่ผันกลับได้ ซึ่งแบ่งเป็น 3 ประเภท ดังนี้
1.) การเปลี่ยนสถานะ
เช่น การกลายเป็นไอของน้ำในภาชนะปิด น้ำเปลี่ยนสถานะจากของเหลวเป็นแก๊ส
H2O(l) ⇌ H2O(g)
หรือการระเหิดของไอโอดีนในภาชนะปิด ซึ่งเปลี่ยนสถานะไอโอดีนจากของแข็งเป็นแก๊ส
I2(s) ⇌ I2 (g)
ดังนั้น ในระบบอาจมีการเปลี่ยนสถานะจากของแข็งเป็นของเหลว หรือจากของเหลวเป็นแก๊ส หรือจากแก๊สเป็นของแข็งอย่างใดอย่างหนึ่ง ดังนั้นการเปลี่ยนสถานะที่จะก่อให้เกิดสมดุลเคมีได้ต้องเกิดในระบบปิดเท่านั้น
2) การเกิดสารละลาย
การเกิดสารละลายที่จะก่อให้เกิดสมดุลเคมี เช่น การละลายของเกลือ NaCl ในน้ำได้สารละลาย แต่เมื่อให้ความร้อนจะเกิดเป็นสารละลายอิ่มตัว เมื่ออุณหภูมิลดลงจะเกิดการตกผลึกของเกลือ NaCl กลับมา การเกิดสารละลายลักษณะนี้จึงก่อให้เกิดการเปลี่ยนแปลงที่ผันกลับได้ การละลายของเกลือแกงแสดงดังสมการข้างล่าง(จะต้องละลายจนอิ่มตัวจึงจะเกิดสมดุล)
NaCl (s) + H2O ⇌ Na+(aq) + Cl- (aq)
3) การเกิดปฏิกิริยาเคมี
การเกิดปฏิกิริยาบางปฏิกิริยาสามารถผันกลับได้ และก่อให้เกิดสมดุลเคมี เช่น การละลายของก๊าซ CO2 ในน้ำ อาจจะเกิดการเปลี่ยนแปลงในลักษณะการแพร่ของแก๊ส CO2 ในน้ำ หรืออาจเกิดปฏิกิริยาเคมีกับน้ำได้กรดคาร์บอนิก และกรดคาร์บอนิกสามารถสลายตัวกลับมาเป็นแก๊ส CO2 และ H2O เหมือนเดิม
CO2 (g) + H2O (l) ⇌ H2CO3
ที่มา : https://www.scimath.org/lesson-chemistry/item/11676-2020-06-30-07-35-26
คุณสมบัติของสมดุลเคมี1.ต้องเกิดในระบบปิด2.เกิดการเปลี่ยนแปลงที่ผันกลับได้3. ที่ภาวะสมดุลอัตราการเกิดปฏิกิริยาไปข้างหน้าจะเท่ากับอัตราการเกิดปฏิกิริยาผันกลับ4.มีสารตั้งต้นเหลืออยู่ทุกสารในระบบ5.สมบัติของระบบคงที่
💥 สมดุลไดนามิก 💥
ผลการทดลองนี้ยืนยันได้ว่า ณ ภาวะสมดุลยังมีการเปลี่ยนแปลงเกิดขึ้นตลอดเวลา จึงเรียกสมดุลของสารอิ่มตัวนี้ว่า สมดุลไดนามิก (dynamic Equilibrium) สมดุลไดนามิกแบ่งออกเป็น 2 ประเภท ดังนี้
สมดุลเนื้อเดียวกัน (Homogeneous Chemical Equilibrium) เป็นสมดุลที่มีสารทุกชนิดอยู่ในสถานะเดียวกันหมด
สมดุลเคมีมีเนื้อผสม (Heterogeneous Chemical Equilibrium) เป็นสมดุลที่มีสารต่างๆมากกว่า 2 สถานะอยู่ในระบบเดียวกันหมด
ความสัมพันธ์ระหว่างความเข้มข้นของสารต่างๆ ณ ภาวะสมดุล 👅💟💣
ค่าคงที่สมดุล ปฏิกิริยาที่ผันกลับได้ไม่ว่าจะเริ่มต้นจากสารตั้งต้นที่มีความเข้มข้นเท่าใดก็ตาม ถ้าระบบเข้าสู่ภาวะสมดุลความเข้มข้นของสารต่างๆในระบบจะมีค่าคงที่ ซึ่งนำความเข้มข้นของสารต่างๆมาหาความสัมพันธ์กันพบว่าอัตราส่วนระหว่างผลคูณของความเข้มข้นของผลิตภัณฑ์และแต่ละชนิด ยกกำลัง ด้วยตัวเลขบอกจำนวนโมลของผลิตภัณฑ์นั้นๆกับผลคูณของความเข้มข้นของสารตั้งต้นที่เหลือแต่ละชนิดยกกำลัง ด้วยตัวเลขบอกจำนวนโมลของสารตั้งต้นนั้น จะได้ค่าคงที่เสมอ ณ อุณหภูมิคงที่เรียกว่า ค่าคงที่สมดุล
กำหนดให้สมดุลปฏิกิริยาเป็น aA + bB cC + dD ณ อุณหภูมิค่าหนึ่งจะได้ค่าคงที่สมดุล ( K ) สมดุลจะได้ k<1 สมดุลไปทางขวา Favor products k>1 สมดุลไปทางซ้าย Favor reactants
ข้อสังเกตเกี่ยวกับค่าคงที่ของสมดุล (K)1.ค่า K จะบอกถึงปฏิกิริยาไปข้างหน้ามากเท่าใด2.ค่า K จะบอกปริมาณของผลิตภัณฑ์ที่เกิดขึ้นมากน้อยเพียงใด3.ค่า K ขึ้นอยู่กับอุณหภูมิเท่านั้นความเข้มข้นและความดันไม่มีผลแต่จะมากขึ้นหรือน้อยลงขึ้นกับชนิดของปฏิกิริยา4.ค่า K อาจมีหน่วยหรือไม่มีหน่วยก็ได้ขึ้นอยู่กับสมการเคมี5.ค่า K มิได้เกี่ยวข้องกับอัตราเร็วในการเกิดปฏิกิริยากล่าวคือค่าKมาก Rateของปฏิกิริยาอาจจะเร็วหรือช้าก็ได้6.ค่า K อาจมีค่ามากกว่าน้อยกว่าหรือเท่ากับหนึ่งก็ได้ขึ้นอยู่กับปฏิกิริยานั้น
ค่าคงที่สมดุลกับสมการเคมี 1. เมื่อเขียนสมการของปฏิกิริยาเคมีกลับกันกับสมการเดิม ค่า K ที่จะได้มีค่าเป็นส่วนกลับกับค่า K เดิม คือกลับเศษเป็นส่วนและส่วนเป็นเศษ
2. เมื่อคูณตัวเลขใดเข้าไปในสมการของปฏิกิริยา ค่า K ใหม่ที่ได้จะต้องนำค่า Kเดิมมายกกำลังด้วยตัวเลขที่คูณนั้น
3. ถ้าปฏิกิริยารวม เกิดจากปฏิกิริยาย่อยรวมกัน ค่าคงที่สมดุลจะเท่ากับค่าคงที่สมดุลของปฏิกิริยาย่อยคูณกัน
ในปฏิกิริยาที่มีหลายขั้นตอน
K รวมของปฏิกิริยา = ผลคูณของค่า K ของปฏิกิริยาย่อย
รวม
4. เมื่อหารตัวเลขใดๆเข้าไปในสมการของปฏิกิริยา ค่า K ใหม่ที่ได้จะต้องนำค่า K เดิมมาถอดรากลำดับที่เท่ากับตัวเลขที่หารนั้น
ขั้นตอนการหาค่าคงที่สมดุล 👾👻💢
1. เขียนสมการเคมี2. ดุลสมการเคมี3. ณ จุดสมดุล หาความเข้มข้นของผลิตภัณฑ์4. ณ จุดสมดุล หาความเข้มข้นของ สารตั้งต้นที่เหลือ5. เขียนค่า K และแทนค่าความเข้มข้น ของสารผลิตภัณฑ์ และสารตั้งต้นลงในสมการค่า K
กระบวนการเปลี่ยนแปลงทางวิทยาศาสตร์มี 3 รูปแบบ คือ การเปลี่ยนสถานะ การละลาย และการเกิดปฏิกิริยาเคมี จำแนกเป็น 2 ลักษณะคือ
- การเปลี่ยนแปลงที่เกิดขึ้นทางเดียวไม่ย้อนกลับ (Inreversible reaction) หมายถึงเมื่อสิ่งหนึ่งเปลี่ยนแปลงไปเป็นอีกสิ่งหนึ่งแล้ว สิ่งที่เกิดขึ้นจากการเปลี่ยนแปลงนี้จะไม่สามารถเปลี่ยนกลับมาสู่ภาวะเดิมได้โดยทันที เช่น การเผาไหม้ของสิ่งต่าง ๆ เราไม่สามารถทำให้สิ่งที่เกิดจากการเผาไหม้ เปลี่ยนกลับไปเป็นสารเดิมเหมือนก่อนการเผาไหม้ได้อีก การเปลี่ยนแปลงลักษณะนี้ไม่มีภาวะสมดุล เช่น ปฏิกิริยาการเผาไหม้ดังสมการ
CH4(g) + O2(g) CO2(g) + H2O(g)
- การเปลี่ยนแปลงที่ผันกลับได้หรือย้อนกลับได้ (Reversible reaction) มีลักษณะที่สำคัญคือเมื่อสิ่งหนึ่งเปลี่ยนแปลงไปเป็นสิ่งใหม่แล้ว สิ่งใหม่ที่เกิดขึ้นก็สามารถเปลี่ยนกลับมาเป็นสิ่งเดิมได้ทันที การเปลี่ยนแปลงลักษณะนี้จะเกิดภาวะสมดุลขึ้นได้ เช่น การผลิต ก๊าซแอมโมเนีย (NH3) จากปฏิกิริยาระหว่างก๊าซไฮโดรเจน (H2) กับก๊าซไนโตรเจน (N2) ดังสมการ
3 H2(g) + N2(g) ↔ 2NH3(g)
ในการเกิดปฏิกิริยานี้ ก๊าซ H2 และ N2 เป็นสารตั้งต้น ทำปฏิกิริยากันกลายเป็นก๊าซ NH3 และในทันทีที่เกิดก๊าซ NH3 ก๊าซ NH3 ที่เกิดขึ้นจะสลายตัวกลับไปเป็นก๊าซ H2 และ N2 อย่างเดิม ฉะนั้นในเวลาเดียวกันจึงมีการเปลี่ยนแปลงเกิดขึ้น 2 กระบวนการพร้อมกัน ได้แก่
2.1 ก๊าซ H2 กับ N2 ทำปฏิกิริยากันกลายเป็นก๊าซ NH3 ดังสมการ
3 H2(g) + N2(g) → 2NH3(g)
กระบวนการนี้เกิดขึ้นก่อน เรียกว่าการเปลี่ยนแปลงไปข้างหน้า (forward change หรือ forward reaction)
2.2 ก๊าซ NH3 บางส่วนสลายตัวกลับมาเป็นก๊าซ H2 กับ N2 ตามเดิม ดังสมการ
2NH3(g) → 3H2(g) + N2(g)
กระบวนการนี้เกิดขึ้นทีหลัง เรียกว่าการเปลี่ยนแปลงย้อนกลับ (reverse change หรือ reverse reaction) เมื่อนำการเปลี่ยนแปลงทั้ง 2 มาเขียนไว้ในสมการเดียวกัน รูปของสมการจะเป็นดังนี้
2NH3(g) ⇌ 3H2(g) + N2(g)

ทดสอบปฏิกิริยาไปข้างหน้า (สารตั้งต้นทำปฏิกิริยากันแล้วเกิดเป็นสารผลิตภัณฑ์หรือไม่)
ทดสอบปฏิกิริยาย้อนกลับ (นำสารผลิตภัณฑ์มาทำปฏิกิริยากันแล้วกลับไปเป็นสารตั้งต้นหรือไม่)
สังเกตสมบัติของระบบว่าคงที่หรือไม่ (อาจสังเกตสีว่าคงที่หรือไม่)
การคำนวณค่าคงที่สมดุล
1. ถ้ากลับสมการ ค่า K จะกลับเศษเป็นส่วน
2. ถ้านาสมการมารวมกัน ค่า K จะนามาคูณกัน
3. ถ้าเอาเลขคูณทั้ง สมการ ค่า K นามายกกาลังเลขนั้น
4. ถ้านาสมการมาลบกัน ค่า K จะนามาหารกัน
ผลของการเปลี่ยนแปลงความเข้มข้นความดันและอุณหภูมิ 👄💃👿
1.ผลของการเปลี่ยนแปลงความเข้มข้นที่มีต่อภาวะสมดุล2.ผลของการเปลี่ยนแปลงความดันที่มีผลต่อภาวะสมดุล3.ผลของการเปลี่ยนแปลงอุณหภูมิที่มีต่อภาวะสมดุล
ผลของการเปลี่ยนแปลงความเข้มข้นที่มีต่อภาวะสมดุล 👬😎💫การเพิ่มหรือลดความเข้มข้นของสารหนึ่งสารใดในปฏิกิริยาเคมีเป็นเหตุให้ภาวะสมดุลเปลี่ยนไปแต่ค่าคงที่สมดุลยังคงเดิม เช่น
ถ้าเพิ่มความเข้มข้นของH2 , I2 สมดุลจะเลื่อนไปทางขวา
ผลของการเปลี่ยนแปลงความดันที่มีต่อภาวะสมดุล
ในระบบเคมีที่มีองค์ประกอบเป็นก๊าซ ถ้าความดันของระบบเพิ่มขึ้นสมดุลจะเลื่อนไปทางฝ่ายที่มีจำนวนโมลน้อย -เมื่อจำนวนโมลทั้งสองข้างของปฏิกิริยาเคมีเท่ากัน "ความดันจะไม่มีผลต่อสมดุล"
-เมื่อจำนวนโมลทั้งสองข้างของปฏิกิริยาเคมีไม่เท่ากัน
"ความดันมีผลต่อสมดุล แต่ K ไม่เปลี่ยน"
เพิ่มความดัน (ลด V) ทำให้ระบบเกิดปฏิกิริยาไปในทิศทางที่ทำให้ จำนวนโมลของแก๊สรวมลดลง
ลดความดัน (เพิ่ม V) ทำให้ระบบเกิดปฏิกิริยาไปในทิศทางที่ทำให้ จำนวนโมลของแก๊สรวมเพิ่มขึ้น
ผลของการเปลี่ยนแปลงอุณหภูมิที่มีต่อภาวะสมดุล 〄➼😻
1. ปฏิกิริยาคายความร้อน ถ้าเพิ่มอุณหภูมิสูงขึ้น ผลิตภัณฑ์น้อยลง ค่า K จะลดลง ถ้าลดอุณหภูมิลดลง ผลิตภัณฑ์มากขึ้น ค่า K จะเพิ่มขึ้น
2. ปฏิกิริยาดูดความร้อน ถ้าเพิ่มอุณหภูมิสูงขึ้น ผลิตภัณฑ์มากขึ้นค่า K จะมากขึ้น ถ้าลดอุณหภูมิลดลง ผลิตภัณฑ์น้อยลงค่า K จะลดลง
ลักษณะทั่วไปของภาวะสมดุล 👀💦👰
เมื่อระบบอยู่ในสมดุลแต่มีสิ่งอื่นจากภายนอกมารบกวนระบบเช่น การเปลี่ยนอุณหภูมิ ความดัน สมดุลของระบบจะเสียไปเมื่อหยุดรบกวน ระบบจะเข้าสู่สมดุลใหม่ได้เอง
-----------> เลอชาเตอลิเยร์
การเข้าสู่สมดุลของระบบอาจเริ่มจากทิศใดก็ได้ โดยพยายามลดสิ่งที่รบกวนให้เหลือน้อยที่สุด
หลักของเลอชาเตอลิเอ 🙉💜💭
“เมื่อระบบที่อยู่ในภาวะสมดุล ถูกรบกวนโดยการเปลี่ยนแปลงปัจจัยที่มีผลต่อสมดุล ระบบจะเปลี่ยนแปลงไปในทิศทางที่ลดผลของการรบกวนนั้น เพื่อให้ระบบกลับคืนสู่ภาวะสมดุลอีกครั้ง”เช่น
การใช้หลักของเลอชาเตอลิเอ ในอุตสาหกรรม
2. ถ้านาสมการมารวมกัน ค่า K จะนามาคูณกัน
3. ถ้าเอาเลขคูณทั้ง สมการ ค่า K นามายกกาลังเลขนั้น
4. ถ้านาสมการมาลบกัน ค่า K จะนามาหารกัน
1. ปฏิกิริยาคายความร้อน






ความคิดเห็น
แสดงความคิดเห็น